Около десяти лет назад исследователи начали изучать смелую идею: использовать биолюминесцентный свет, чтобы наблюдать за активностью мозга в реальном времени. Вместо того чтобы освещать мозговую ткань снаружи, они задались вопросом, можно ли заставить нейроны светиться самостоятельно.
Кристофер Мур, профессор нейронаук из Университета Брауна, поясняет: «Мы начали размышлять: а что если бы мы могли осветить мозг изнутри?». Он отмечает, что внешнее освещение мозга традиционно применяется для измерения активности – как правило, с помощью флуоресценции – или для стимуляции клеточной активности, чтобы изучить их роль. Однако, по словам Мура, использование лазеров в экспериментах сопряжено с недостатками, часто требуя сложного оборудования и не гарантируя высокого успеха. Ученые предположили, что биолюминесценция могла бы стать более эффективной альтернативой.
Эта идея в 2017 году привела к созданию Центра биолюминесценции (Bioluminescence Hub) при Институте нейронаук Карни Университета Брауна. При поддержке крупного гранта Национального научного фонда центр объединил таких исследователей, как Мур (заместитель директора Института Карни), Дайан Липскомб (директор института), Уте Хохгешвендер (Университет Центрального Мичигана) и Натан Шейнер (Калифорнийский университет в Сан-Диего). Команда поставила перед собой цель – разработать и распространить новые нейробиологические инструменты, предоставив клеткам нервной системы способность генерировать свет и реагировать на него.
В исследовании, опубликованном в журнале Nature Methods, ученые представили разработанный ими новый инструмент биолюминесцентной визуализации. Этот инструмент, получивший название Ca2+ BioLuminescence Activity Monitor (сокращенно «CaBLAM»), способен с высокой скоростью регистрировать активность как в отдельных клетках, так и в их мельчайших участках. Он эффективно работает на мышах и данио-рерио, позволяет проводить многочасовые записи и не требует внешнего источника света.
По словам Мура, Натан Шейнер, доцент кафедры нейронаук и фармакологии Калифорнийского университета в Сан-Диего, руководил разработкой молекулярной основы «CaBLAM». «CaBLAM» – это действительно удивительная молекула, созданная Натаном, – подчеркивает Мур, – и она полностью оправдывает свое название».
Отслеживание активности живых клеток мозга имеет решающее значение для понимания функционирования организмов, объясняет Мур. В настоящее время наиболее распространенный метод основан на генетически кодируемых индикаторах ионов кальция, использующих флуоресценцию. Мур, возглавляющий Центр биолюминесценции, описывает принцип работы флуоресценции: «Вы направляете световые лучи на объект, а в ответ получаете световые лучи другой длины волны». Он добавляет, что этот процесс можно сделать чувствительным к кальцию, создавая белки, которые будут испускать свет с разной интенсивностью или цветом в зависимости от присутствия кальция, обеспечивая яркий сигнал.
Несмотря на широкое распространение флуоресцентных методов, Мур отмечает их существенные недостатки. Длительное воздействие интенсивного внешнего света способно повредить клетки мозга. Со временем такое освещение также может изменять сами флуоресцентные молекулы, из-за чего они перестают испускать достаточно света – проблема, известная как фотообесцвечивание, которая ограничивает продолжительность экспериментов. Кроме того, подача света в мозг требует использования такого оборудования, как лазеры и оптические волокна, что делает эксперименты более инвазивными.
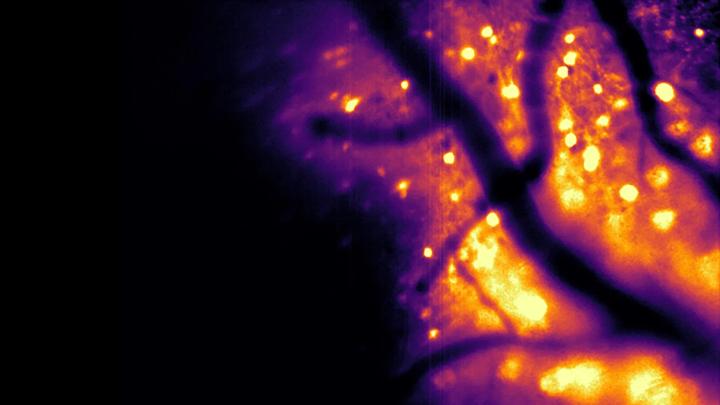
Биолюминесцентная визуализация функционирует иначе. Свет генерируется, когда фермент расщепляет определенную небольшую молекулу, что устраняет необходимость в ярком внешнем освещении. Как следствие, отсутствует фотообесцвечивание и фототоксическое повреждение, что делает этот подход более безопасным для деликатных тканей мозга.
Этот метод также позволяет получать более четкие изображения. Шейнер объясняет: «Мозговая ткань сама по себе слабо светится при воздействии внешнего света, создавая фоновый шум». Он добавляет, что мозговая ткань также рассеивает свет, размывая как входящий свет, так и исходящий сигнал. Это делает изображения более тусклыми, нечеткими, и затрудняет наблюдение за глубокими участками мозга. Поскольку мозг естественным образом не производит биолюминесценцию, искусственно созданные нейроны, светящиеся самостоятельно, выделяются на темном фоне практически без помех. Благодаря биолюминесценции, по словам Шейнера, клетки мозга действуют как собственные «фары»: нужно лишь наблюдать за выходящим светом, который гораздо легче различить даже после рассеяния в тканях.
Мур подчеркнул, что ученые десятилетиями обсуждали возможность использования биолюминесценции для изучения активности мозга, но до сих пор никому не удавалось сделать этот свет достаточно ярким для детальной визуализации.
«Нынешняя работа интересна по многим причинам, – комментирует Мур. – Эти новые молекулы впервые предоставили возможность наблюдать за независимо активирующимися отдельными клетками, почти как если бы вы использовали очень специальную, чувствительную видеокамеру для записи мозговой активности в момент ее возникновения».
С помощью «CaBLAM» исследователи могут наблюдать за поведением отдельных нейронов внутри живого организма, включая активность в различных частях клетки. В ходе исследования команда сообщила о непрерывной пятичасовой записи, что было бы невозможно при использовании традиционных флуоресцентных методов.
«Для изучения сложного поведения или процессов обучения биолюминесценция позволяет запечатлеть весь процесс, причем с использованием меньшего количества оборудования», – утверждает Мур.
Проект «CaBLAM» – это часть более масштабных усилий центра по изобретению новых способов наблюдения и контроля мозговой активности. Один из экспериментов включает живую клетку, испускающую вспышку света, которую может обнаружить соседняя клетка, позволяя нейронам общаться с помощью самого света (что Мур называет «перепрограммированием мозга светом»). Команда также разрабатывает методы, использующие кальций для регуляции клеточной активности.
По мере развития этих проектов исследователи осознали, что все они зависят от наличия более ярких и эффективных кальциевых сенсоров. Эта потребность, по словам Мура, стала центральным направлением работы центра.
Мур полагает, что «CaBLAM» в конечном итоге может быть применен не только в нейронауках, но и для изучения активности в других частях тела. «Этот прорыв открывает совершенно новые возможности для понимания работы мозга и организма, – заявляет Мур, – включая одновременное отслеживание активности в нескольких частях тела».
Он добавил, что это достижение подчеркивает силу совместных исследований. В проекте приняли участие по меньшей мере 34 ученых, представляющих партнеров Центра биолюминесценции, такие как Университет Брауна, Университет Центрального Мичигана, Калифорнийский университет в Сан-Диего, Калифорнийский университет в Лос-Анджелесе и Нью-Йоркский университет. Работа была поддержана финансированием от Национальных институтов здравоохранения, Национального научного фонда и семейного фонда Пола Аллена.