Международная группа ученых из Немецкого центра приматов – Лейбниц-института исследований приматов (DPZ), Ганноверской медицинской школы (MHH) и Института молекулярной клеточной биологии и генетики Общества Макса Планка раскрыла клеточные механизмы, лежащие в основе микроцефалии – аномально малого размера мозга, наблюдаемого у некоторых детей. Исследователи использовали органоиды человеческого мозга, выращенные в лаборатории, чтобы детально изучить, как изменения в ключевых структурных белках внутри клеток могут влиять на раннее развитие мозга.
Результаты, опубликованные в журнале EMBO Reports, демонстрируют, что мутации в генах актина нарушают процесс деления клеток-предшественников мозга. Когда эти клетки не делятся должным образом, их количество сокращается, что ограничивает общий рост мозга и приводит к его уменьшению. «Наши данные предоставляют первое клеточное объяснение микроцефалии у людей с редким синдромом Барайтсера-Винтера», – заявляет Индра Нихаус, первый автор исследования и научный сотрудник Ганноверской медицинской школы.
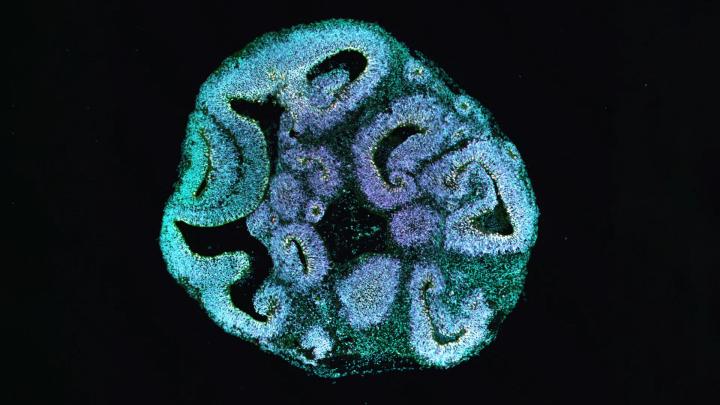
Актин играет центральную роль в цитоскелете – внутреннем каркасе, который придает клеткам структуру и помогает перемещать материалы внутри них. У пациентов с синдромом Барайтсера-Винтера мутация затрагивает один из двух важнейших актиновых генов. Чтобы понять последствия этого, ученые перепрограммировали клетки кожи таких пациентов в индуцированные плюрипотентные стволовые клетки. Из этих стволовых клеток затем были выращены трехмерные органоиды мозга, имитирующие ранние стадии формирования человеческого мозга.
Уже через тридцать дней развития различия были поразительными. Органоиды, выращенные из клеток пациентов, были примерно на 25 процентов меньше, чем органоиды, полученные из клеток здоровых доноров. Желудочкоподобные области внутри органоидов, где группируются клетки-предшественники и начинают формировать ранние нервные клетки, также оказались значительно меньше.
При исследовании типов клеток внутри органоидов ученые обнаружили явный дисбаланс. Количество апикальных клеток-предшественников, которые необходимы для построения коры головного мозга, было значительно ниже. В то же время наблюдалось увеличение числа базальных клеток-предшественников, которые обычно появляются позже по мере развития. Этот сдвиг указывал на нарушение времени и результата клеточного деления, что потенциально объясняло, почему мозговая ткань не смогла нормально расширяться.
Используя микроскопию высокого разрешения, команда тщательно отслеживала, как делятся апикальные клетки-предшественники. В нормальных условиях эти клетки делятся преимущественно под прямым углом к желудочковой поверхности. Такая ориентация обеспечивает равномерное распределение клеточных компонентов и образование двух новых апикальных клеток-предшественников. В органоидах, несущих мутацию актина, этот паттерн резко изменился. Вертикальные деления стали встречаться гораздо реже, тогда как горизонтальные и угловые деления доминировали. В результате апикальные клетки-предшественники стали менее способны к самообновлению. Они чаще отделялись от желудочковой зоны и с большей вероятностью превращались в базальные клетки-предшественники. «Наши анализы очень четко показывают, что изменение ориентации деления клеток-предшественников является решающим фактором уменьшения размера мозга», – говорит Михаэль Хайде, руководитель группы в Немецком центре приматов и последний автор исследования. – «Единственное изменение в цитоскелете достаточно, чтобы нарушить ход раннего развития мозга».
Электронная микроскопия выявила дополнительные, едва заметные дефекты на желудочковой поверхности. Формы клеток выглядели неровными, а между соседними клетками образовывались дополнительные выросты. Исследователи также наблюдали необычно высокие уровни тубулина в клеточных контактах. Тубулин – это еще один белок цитоскелета, играющий ключевую роль в делении клеток. Хотя общая структура клеток оставалась нетронутой, этих небольших аномалий может быть достаточно, чтобы окончательно изменить ориентацию клеток во время деления.
Чтобы подтвердить, что наблюдаемые различия действительно были вызваны мутацией актина, а не другими генетическими вариациями, ученые провели критический контрольный эксперимент. Они использовали технологию CRISPR/Cas9 для введения точно такой же мутации в здоровую линию стволовых клеток. Органоиды мозга, выращенные из этих отредактированных клеток, развивали те же дефекты, что и органоиды, полученные от пациентов, – доказательство того, что именно мутация является движущим фактором.
Эти открытия проливают свет на то, как редкие генетические мутации могут приводить к сложным порокам развития мозга, и демонстрируют ценность органоидов мозга в биомедицинских исследованиях. «Наши результаты помогают нам понять, как редкие генетические расстройства приводят к сложным порокам развития мозга, и подчеркивают потенциал органоидов мозга для биомедицинских исследований», – отмечает Михаэль Хайде.
«Терапевтический потенциал этого исследования заключается в диагностике, поскольку наши данные помогают лучше классифицировать генетические находки у пациентов. Поскольку заболевание затрагивает процессы раннего внутриутробного развития, прямые вмешательства у человека были бы сложными. Однако новые препараты, влияющие на взаимодействие между актином и микротрубочками, могли бы открыть новые подходы в долгосрочной перспективе», – объясняет Наталия Ди Донато, директор Института генетики человека Ганноверской медицинской школы.