На пути к лучшему пониманию работы нервной системы исследователи из Университета Тулейн в сотрудничестве с учеными из восьми других учреждений выявили ранее неизвестный способ передачи сообщений нервными клетками. Это открытие может существенно изменить существующие представления о боли и указать направление для разработки более безопасных и эффективных методов ее лечения.
Исследование возглавили Мэттью Далва, директор Института мозга Тулейн и профессор клеточной и молекулярной биологии, совместно с Тедом Прайсом из Техасского университета в Далласе. Их работа, опубликованная в журнале Science, демонстрирует, что нейроны могут выделять во внеклеточное пространство фермент, который активирует болевые сигналы после травмы. Полученные результаты также проливают новый свет на механизмы укрепления связей между клетками мозга, играющие ключевую роль в процессах обучения и памяти.
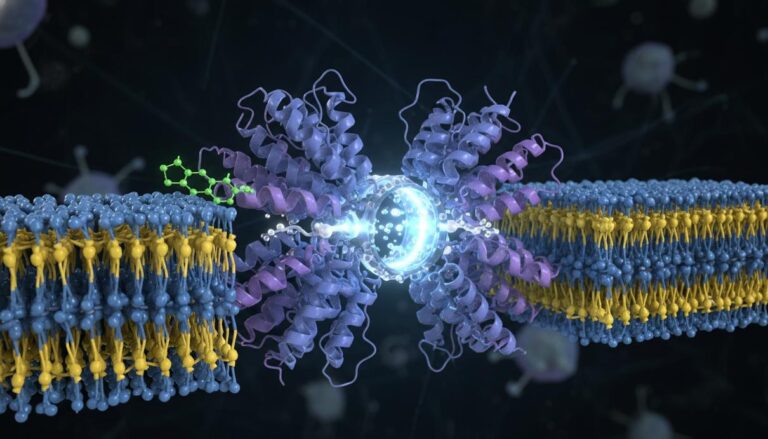
«Это открытие принципиально меняет наше фундаментальное понимание того, как общаются нейроны», – комментирует Далва. Ученые обнаружили, что нейроны могут выделять фермент, который изменяет белки на поверхности других клеток, запуская болевую сигнализацию – и при этом не затрагивая нормальное движение или ощущения. Этот фермент был идентифицирован как киназа VLK (vertebrate lonesome kinase). Нейроны используют VLK для коммуникации во внеклеточном пространстве, где он изменяет соседние белки, влияя на передачу сигналов между нервными клетками.
«Это одно из первых доказательств того, что фосфорилирование может контролировать взаимодействие клеток во внеклеточном пространстве», – подчеркивает Далва. Открытие открывает совершенно новый взгляд на способы воздействия на клеточное поведение и, возможно, предлагает более простой подход к разработке лекарственных препаратов, действующих извне клетки, без необходимости проникать внутрь.
Команда исследователей выяснила, что активные нейроны выделяют VLK, что приводит к усилению активности рецептора, участвующего в болевых ощущениях, обучении и памяти. Когда ученые удаляли фермент VLK из болечувствительных нейронов у мышей, животные не испытывали обычной послеоперационной боли, сохраняя при этом нормальные двигательные и сенсорные функции. Напротив, при повышении уровней VLK болевые реакции усиливались.
«Это исследование доходит до сути того, как работает синаптическая пластичность – как развиваются связи между нейронами», – говорит Прайс, директор Центра передовых исследований боли и профессор неврологии в Школе поведенческих и мозговых наук Техасского университета в Далласе. – «Оно имеет очень широкие последствия для нейробиологии, особенно в понимании того, как боль и обучение используют схожие молекулярные механизмы».
Далва отмечает, что полученные результаты указывают на более безопасную стратегию изменения болевых путей. Теперь можно сосредоточиться на ферментах, таких как VLK, вместо блокирования NMDA-рецепторов. NMDA-рецепторы регулируют коммуникацию между нейронами, но их нарушения могут вызывать значительные побочные эффекты. Это исследование также является одним из первых примеров того, как можно влиять на взаимодействие белков на поверхности клетки без проникновения внутрь самой клетки. Далва считает, что это может упростить разработку лекарств и снизить нежелательные побочные эффекты, поскольку терапевтический агент будет действовать исключительно вне клетки.
Следующие шаги включают определение того, влияет ли этот механизм только на небольшую группу белков или же представляет собой более широкий биологический процесс, который до сих пор оставался незамеченным. Если окажется, что он широко распространен, это может пересмотреть стратегии лечения неврологических и других заболеваний.
Исследование было проведено в партнерстве с коллегами из Медицинского научного центра Техасского университета в Сан-Антонио, Онкологического центра MD Anderson Техасского университета, Университета Хьюстона, Принстонского университета, Университета Висконсин–Мэдисон, Медицинской школы Гроссмана Нью-Йоркского университета и Университета Томаса Джефферсона. Проект получил поддержку грантов от Национального института неврологических расстройств и инсульта, Национального института по проблемам злоупотребления наркотиками и Национального центра исследовательских ресурсов – все они являются частью Национальных институтов здравоохранения США. Соавторами, чьи имена указаны первыми, являются доктор Сравья Коллуру, доктор Правин Чандер и доктор Кристина Уошберн, все они члены Лаборатории Далвы в Тулейне.