Ежегодно с приходом холодов миллионы людей сталкиваются с неприятными симптомами гриппа – лихорадкой, ломотой в теле и насморком. Это вирусное заболевание, вызываемое вирусами гриппа, проникает в наш организм воздушно-капельным путем, находя и инфицируя уязвимые клетки.
Недавно международная команда исследователей из Швейцарии и Японии получила беспрецедентно детальное представление о механизме проникновения вируса гриппа в клетку. Специалисты разработали уникальный микроскопический подход, который позволяет в реальном времени и с высочайшей точностью наблюдать за тем, как вирус проникает через внешнюю поверхность живых человеческих клеток в чашке Петри.
Под руководством профессора молекулярной медицины Йохея Ямаучи из Высшей технической школы Цюриха (ETH Zurich) команда сделала неожиданное открытие. Оказалось, что клетки не остаются пассивными наблюдателями, когда вирус гриппа приближается. Напротив, они активно способствуют его захвату. Сам Ямаучи описывает процесс инфицирования как «танец между вирусом и клеткой».
Несмотря на то что инфицирование не приносит клеткам никакой пользы, их взаимодействие с вирусом носит активный характер. Выяснилось, что вирус мастерски использует обычную клеточную систему поглощения, от которой клетки не могут отказаться. Эта система жизненно необходима для транспортировки внутрь клетки различных важных веществ, таких как гормоны, холестерин или железо.
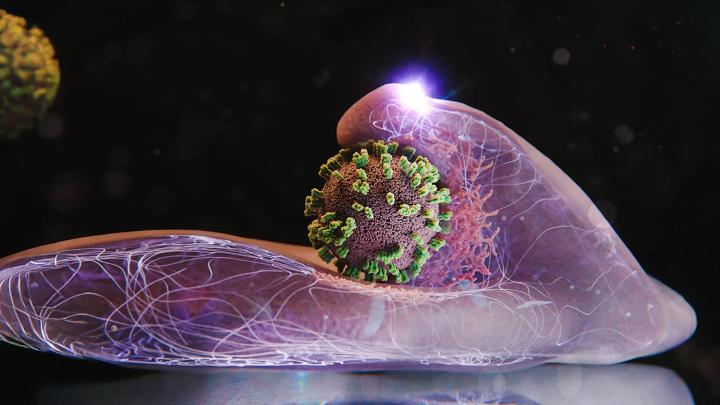
Для начала процесса заражения вирус гриппа прикрепляется к специфическим молекулам на клеточной поверхности. Этот процесс напоминает скольжение или «серфинг» по мембране: вирус перемещается, цепляясь за одну молекулу за другой, пока не достигает участка, богатого такими рецепторами. Место с высокой концентрацией рецепторов обеспечивает наиболее эффективный путь проникновения внутрь.
Когда клеточные рецепторы фиксируют прикрепление вируса, мембрана в этом месте начинает образовывать небольшое углубление. Структурный белок под названием clathrin активно формирует и поддерживает эту углубляющуюся полость. По мере расширения полость полностью обволакивает вирус, образуя везикулу – небольшой «пузырек». Затем клетка втягивает эту везикулу внутрь, где ее оболочка растворяется, высвобождая вирус в цитоплазму.
Ранее исследователи сталкивались с серьезными ограничениями при изучении этого критического момента инфицирования. Доступные методы, такие как электронная микроскопия, требовали разрушения клеток для получения изображения, что позволяло зафиксировать лишь отдельные «снимки» процесса, а не его динамику. Флуоресцентная микроскопия, хотя и предлагала возможность живой визуализации, страдала от низкой пространственной разрешающей способности, не позволяя рассмотреть тонкие детали.
Революцию в этом направлении принес новый метод, получивший название virus-view dual confocal and AFM (ViViD-AFM). Он объединяет атомно-силовую микроскопию (AFM) с флуоресцентной микроскопией, что позволяет отслеживать мельчайшие движения, сопровождающие проникновение вируса в клетку, с беспрецедентной детализацией.
Именно с помощью ViViD-AFM ученые смогли доказать, что клетки активно помогают вирусу на нескольких этапах его проникновения. К примеру, они «призывают» важные белки clathrin к месту прикрепления вируса. Мембрана в этой точке также активно выпячивается наружу, словно пытаясь захватить вирус. Такие волнообразные движения усиливаются, если вирус пытается оторваться от поверхности клетки.
Эти открытия имеют существенное значение для разработки новых противовирусных препаратов. Возможность наблюдать за процессом инфицирования в реальном времени с помощью ViViD-AFM предоставляет ценный инструмент для прямого тестирования потенциальных лекарств в клеточных культурах, оценивая их эффективность на самых ранних стадиях взаимодействия вируса с клеткой. Кроме того, команда исследователей предполагает, что разработанная методика может быть успешно применена для изучения других вирусов, а также механизмов действия вакцин, обеспечивая наглядное представление о взаимодействии этих частиц с клетками.