Кишечник человека обновляет свои клетки быстрее, чем любая другая ткань в организме. Каждые несколько дней специализированные стволовые клетки производят новые клетки, поддерживая здоровье слизистой оболочки. Однако со временем эти стволовые клетки начинают накапливать эпигенетические изменения. Так называют химические метки, прикрепленные к ДНК, которые работают как своего рода переключатели, контролируя, какие гены остаются активными, а какие «выключаются».
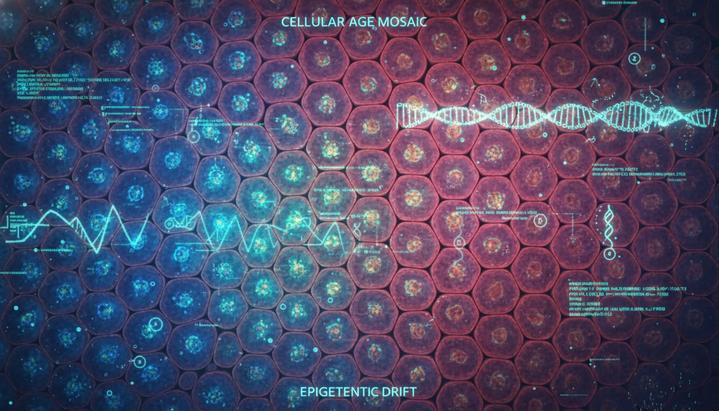
Новое исследование, опубликованное в журнале Nature Aging, показывает, что эти изменения происходят не случайным образом, а следуют четкой закономерности. Международная группа ученых под руководством профессора Франческо Нери из Туринского университета в Италии выявила процесс, который они назвали ACCA-дрейфом (от английского Aging- and Colon Cancer-Associated – «связанный со старением и раком толстой кишки»). Это постепенное смещение эпигенетических маркеров, которое становится все более выраженным с возрастом. «Мы наблюдаем эпигенетический паттерн, который становится все более очевидным по мере старения», – комментирует профессор Нери.
Гены, наиболее подверженные этому дрейфу, отвечают за поддержание нормального баланса тканей. Многие из них участвуют в обновлении слизистой оболочки кишечника через сигнальный путь Wnt. Когда работа этих генов нарушается, способность кишечника к самовосстановлению начинает ослабевать. Исследователи обнаружили, что тот же самый паттерн дрейфа проявляется не только в стареющих тканях кишечника, но и почти во всех проанализированных образцах рака толстой кишки. Это совпадение позволяет предположить, что стареющие стволовые клетки могут создавать условия, способствующие развитию онкологических заболеваний.
Одно из поразительных открытий заключается в том, что кишечник стареет неравномерно. Он состоит из крошечных структур, называемых криптами, каждая из которых формируется из одной стволовой клетки. Если в этой клетке происходят эпигенетические изменения, они наследуются всеми остальными клетками внутри крипты. «Со временем в ткани появляется все больше областей с более старым эпигенетическим профилем. В ходе естественного процесса деления крипт эти участки постоянно расширяются и могут расти в течение многих лет», – объясняет доктор Анна Крепелова. В результате кишечник пожилого человека превращается в мозаику из «молодых» и «старых» крипт, где одни участки остаются здоровыми, а другие с большей вероятностью производят поврежденные клетки.
Ученые также выяснили, почему происходит этот эпигенетический дрейф. По мере старения клетки кишечника начинают поглощать меньше железа и при этом активнее его высвобождать. Это снижает количество доступного двухвалентного железа в клеточном ядре, которое необходимо для правильной работы ферментов TET. Эти ферменты в норме помогают удалять избыточные метильные группы с ДНК – один из видов эпигенетических меток. При падении уровня железа ферменты перестают работать эффективно, и лишние метки остаются на ДНК. «Когда в клетках не хватает железа, на ДНК остаются ошибочные метки, и клетки теряют способность их удалять», – говорит доктор Крепелова. В результате ключевые гены «замолкают», что еще больше ускоряет эпигенетический дрейф.
Возрастное воспаление в кишечнике усугубляет проблему. Команда показала, что даже слабые воспалительные сигналы могут нарушать баланс железа внутри клеток и ослаблять сигнальный путь Wnt, снижая способность стволовых клеток оставаться активными и здоровыми. Сочетание дефицита железа, воспаления и ослабления Wnt-сигналинга действует как ускоритель старения кишечника.
Несмотря на сложность этих процессов, полученные данные дают некоторую надежду. В лабораторных экспериментах с использованием органоидов – миниатюрных моделей кишечника, выращенных из стволовых клеток, – исследователям удалось замедлить или частично обратить вспять эпигенетический дрейф. Они достигли этого, восстановив поглощение железа или напрямую стимулируя сигнальный путь Wnt. Оба подхода реактивировали ферменты TET и позволили клеткам снова начать очищать ДНК от избыточных меток. «Это означает, что эпигенетическое старение не обязательно является необратимым состоянием, – заключает доктор Крепелова. – Впервые мы видим возможность влиять на параметры старения, заложенные глубоко на молекулярном уровне клетки».