За последнее десятилетие Т-клеточная иммунотерапия стала одним из самых многообещающих направлений в лечении онкологических заболеваний. Эти методы лечения работают, обучая собственную иммунную систему пациента обнаруживать и уничтожать опасные клетки. Однако, несмотря на их успех, ученые долгое время не могли полностью объяснить молекулярный механизм действия этих терапий. Отсутствие такого понимания замедляло прогресс, особенно учитывая, что Т-клеточные терапии эффективны лишь для небольшого числа типов рака и часто терпят неудачу в большинстве других случаев по неясным причинам. Глубокое изучение их принципов работы могло бы сделать эти терапии действенными для гораздо большего числа пациентов.
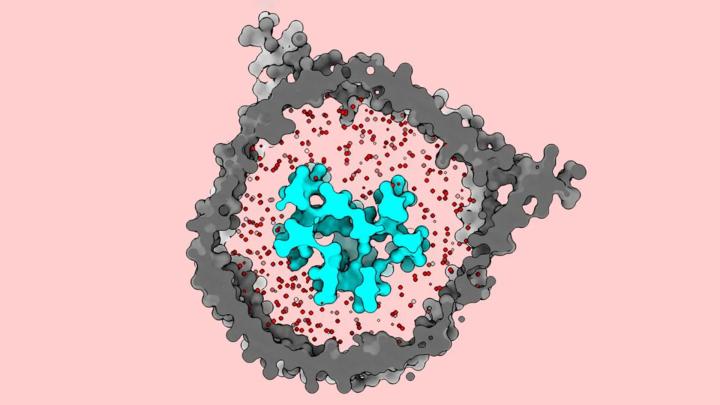
Команда ученых из Университета Рокфеллера недавно раскрыла важнейшие детали о Т-клеточном рецепторе (TCR) — белковом комплексе, встроенном в клеточную мембрану и играющем центральную роль в Т-клеточной терапии. Используя криоэлектронную микроскопию (крио-ЭМ), исследователи из Лаборатории молекулярной электронной микроскопии изучили рецептор в биохимической среде, максимально приближенной к его естественному окружению. Они обнаружили, что TCR ведет себя как «чёрт из табакерки»: он остается компактным до тех пор, пока не встретит антиген или другую подозрительную частицу, после чего быстро раскрывается. Такое поведение противоречит предыдущим крио-ЭМ исследованиям этого рецептора.
Результаты исследования, опубликованные в журнале Nature Communications, могут помочь ученым улучшить и расширить применение Т-клеточной иммунотерапии.
«Это новое фундаментальное понимание работы сигнальной системы может помочь перепроектировать следующее поколение методов лечения», — отмечает первый автор Райан Нотти, преподаватель клинических исследований в лаборатории Вальца и специальный сотрудник Отделения медицины в Онкологическом центре имени Слоуна–Кеттеринга, где он лечит пациентов с саркомами — раковыми заболеваниями мягких тканей или костей.
Вальц, всемирно известный эксперт в области крио-ЭМ изображения, добавляет: «Т-клеточный рецептор является основой практически всех онкологических иммунотерапий, поэтому удивительно, что мы используем эту систему, но на самом деле не имели представления о том, как она работает — именно здесь вступает в игру фундаментальная наука. Это одна из самых важных работ, когда-либо выполненных в моей лаборатории».
Лаборатория Вальца специализируется на получении подробных изображений макромолекулярных комплексов, особенно белков клеточных мембран, которые помогают клеткам обмениваться информацией с окружающей средой. TCR — один из таких комплексов. Состоящий из множества белков, он позволяет Т-клеткам распознавать антигены, представленные комплексами человеческого лейкоцитарного антигена (HLA) на других клетках. Именно на этом процессе распознавания основана работа Т-клеточных терапий, мобилизующих иммунную систему против рака.
Хотя индивидуальные компоненты TCR были известны ученым в течение многих лет, самые ранние шаги, запускающие его активацию, оставались загадкой. Нотти, работающий одновременно врачом и исследователем, считал этот пробел особенно тревожным, поскольку многие из его пациентов с саркомами не получали пользы от Т-клеточных иммунотерапий.
«Определение этих шагов помогло бы нам понять, как информация поступает извне клетки, где эти антигены представляются HLA, внутрь клетки, где происходит активация Т-клетки», — поясняет он.
Нотти получил докторскую степень по структурной микробиологии в Рокфеллеровском университете, прежде чем перейти в онкологию, и предложил Вальцу вместе исследовать этот неразгаданный вопрос.
Команда Вальца известна созданием индивидуальных мембранных сред, которые точно имитируют естественное окружение мембранных белков. «Мы можем изменять биохимический состав, толщину мембраны, натяжение и кривизну, размер — все те параметры, которые, как мы знаем, влияют на встроенный белок», — говорит Вальц.
Для этого исследования ученые стремились наблюдать TCR в условиях, максимально похожих на условия внутри живой клетки. Они поместили рецептор в нанодиск — крошечный дискообразный участок мембраны, удерживаемый в растворе белком-каркасом, обернутым по краю. Сборка полного рецептора оказалась непростой задачей, и «правильная сборка всех восьми этих белков в нанодиск была вызовом», — отмечает Нотти.
Предыдущие структурные исследования TCR полагались на детергенты, которые часто разрушают окружающую мембрану. Вальц подчеркивает, что это был первый случай, когда рецепторный комплекс был восстановлен в мембранной среде для детальной визуализации.
После того как TCR был встроен в нанодиск, исследователи использовали крио-ЭМ для его визуализации. Изображения показали, что рецептор остается закрытым и компактным в неактивном состоянии. Однако, когда он сталкивается с антиген-презентирующей молекулой, структура открывается и вытягивается наружу, напоминая широко раскрывающееся движение.
Результат удивил команду. «Данные, доступные на момент начала этого исследования, изображали этот комплекс как открытый и вытянутый в его неактивном состоянии, — объясняет Нотти. — Насколько было известно, Т-клеточный рецептор не претерпевал никаких конформационных изменений при связывании с этими антигенами. Но мы обнаружили, что это происходит, он раскрывается, словно «чёрт из табакерки».
Исследователи считают, что два фактора сделали это открытие возможным. Во-первых, они тщательно воссоздали мембранную среду TCR in vivo, используя правильную смесь липидов. Во-вторых, они повторно встроили рецептор в мембрану с помощью нанодисков перед проведением крио-ЭМ визуализации. Они обнаружили, что интактная мембрана удерживает рецептор в закрытом положении до момента активации. В более ранних исследованиях детергент мог устранить это ограничение, позволяя рецептору открываться преждевременно.
«Было важно, что мы использовали смесь липидов, которая напоминала липиды нативной мембраны Т-клеток, — утверждает Вальц. — Если бы мы использовали просто модель липида, мы бы также не увидели этого закрытого неактивного состояния».
Команда полагает, что их выводы могут помочь улучшить методы лечения, основанные на Т-клеточных рецепторах. «Перепроектирование следующего поколения иммунотерапий занимает первое место в списке неудовлетворенных клинических потребностей, — говорит Нотти. — Например, адоптивные Т-клеточные терапии успешно используются для лечения некоторых очень редких сарком, поэтому можно представить, как, используя наши знания, можно перепроектировать чувствительность этих рецепторов, настраивая их порог активации».
Вальц также видит потенциальные применения за пределами терапии рака. «Эта информация может быть использована и для разработки вакцин, — добавляет он. — Специалисты в этой области теперь могут использовать наши структуры, чтобы увидеть уточненные детали взаимодействий между различными антигенами, представленными HLA, и Т-клеточными рецепторами. Эти различные режимы взаимодействия могут иметь некоторые последствия для того, как функционирует рецептор, — и как его можно оптимизировать».